实验室赵金存团队首次解析SARS-CoV-2感染小鼠T细胞应答
2021-01-253734实验室赵金存教授团队与广州海关技术中心国家生物安全检测重点实验室(P3实验室)、病原微生物生物安全国家重点实验室合作,应用表达新冠病毒受体人ACE2的腺病毒转导小鼠,首次在小鼠体内解析新冠病毒感染后小鼠T细胞免疫应答特性与功能,此研究将极大推进新型冠状病毒感染细胞免疫应答研究,为SARS-CoV-2致病机制解析及新型疫苗研发提供理论基础和支撑。该研究成果于2021年1月19日在线发表于国际权威杂志 Journal of Experimental Medicine(IF:11.743)。

新型冠状病毒SARS-CoV-2入侵受体为 human angiotensin-converting enzyme 2(hACE2),而小鼠同源受体mouse ACE2由于关键氨基酸位点差异,不能介导病毒入侵,因此我们应用本团队前期构建的Ad5-ACE2转导小鼠模型(Cell, 2020),首先鉴定出在常用近交系小鼠(BALB/c, C57BL/6)中,SARS-CoV-2优势CD4+ T以及CD8+ T 细胞表位(如图1)。
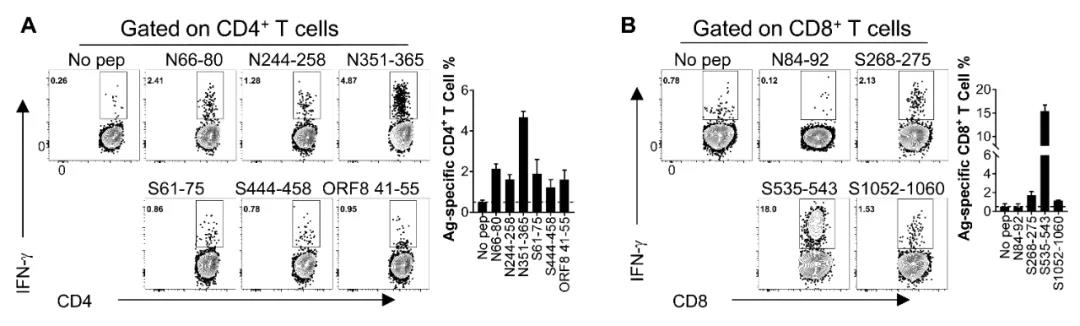
图1. BALB/c小鼠中SARS-CoV-2特异性T细胞表位鉴定结果
为进一步了解SARS-CoV-2感染所诱导的特异性细胞免疫应答规律及功能,作者分析了不同品系小鼠感染后不同时间点不同组织器官中特异性T细胞应答,发现不同小鼠病毒特异性T细胞应答均于感染后第8天达到高峰,肺脏中的病毒特异性T细胞应答远高于二级淋巴器官。感染部位病毒特异性T细胞具有更强的多功能性,且对靶细胞具有较强的杀伤能力(如图2)。使用单独表达T细胞表位的疫苗载体免疫可使小鼠在SARS-CoV-2感染后更快的清除病毒,并减轻肺部病理损伤(如图3)。
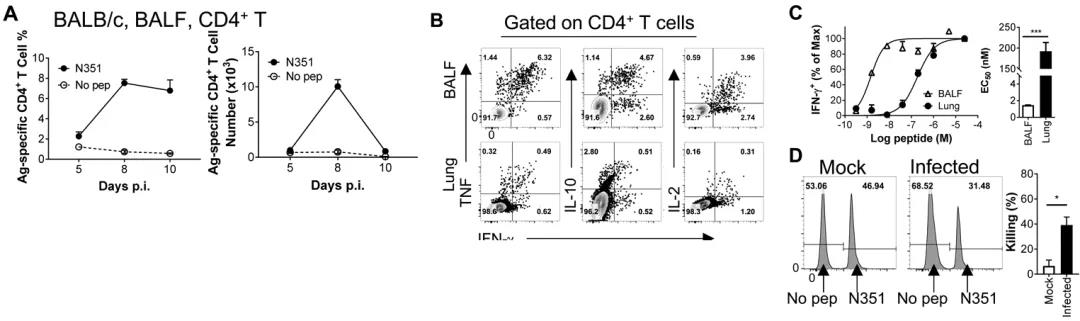
图2. BALB/c小鼠中SARS-CoV-2特异性T细胞应答规律、分泌多种细胞因子、亲和力较高、具有体内杀伤能力
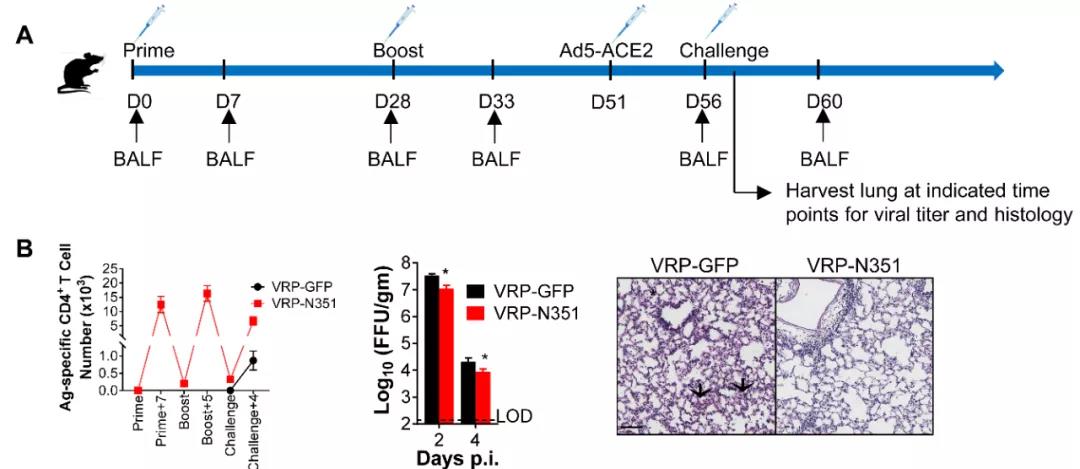
图3. N351特异性记忆CD4+ T细胞可以加速小鼠肺脏SARS-CoV-2的清除、并减轻肺部病理损伤。
此外,本研究还揭示了I型干扰素信号通路可以“塑造”病毒特异性T细胞应答,I型干扰素受体缺陷小鼠T细胞应答减弱、多细胞因子分泌能力降低、抗原亲和力下降。进一步,作者首次在小鼠中阐明了高致病性人冠状病毒之间的交叉反应性T细胞应答情况,为7种人冠状病毒之间交叉反应的探索及功能验证奠定基础。 9
实验室赵金存、肇静娴教授和病原微生物生物安全国家重点实验室周冬生教授为本文共同通讯作者,实验室庄珍博士、赖小敏硕士、孙静博士、陈钊硕士、张昭勇硕士、刘冬兰博士、李玉明博士、李芳博士、以及广州海关技术中心国家生物安全检测重点实验室(P3实验室)戴俊博士为本文并列第一作者。该项目得到了重点研发计划(2018YFC1200100, 2020YFC0842400)、国自然(82025001, 91842106, 81901623)、科技部及教育厅SARS-CoV-2防治应急专项(2020B1111330001, 2020A111128008, 2020B1111320003, 2020KZDZX1158, B195001248)、广州市及广东省科技计划项目(202008040005,2018A030310177)以及实验室自主课题项目(SKLRD-QN-201912)等项目的资助。