钟南山院士率领团队在STTT上发表封面论文揭示新冠病毒诱发宿主炎症的新机制
2022-08-253187近日,广州医科大学钟南山院士团队联合中山大学周文良教授团队,在新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)诱发宿主炎症机制方面取得重要进展,相关研究成果作为原创性研究论文以“SARS-CoV-2 nucleocapsid protein triggers hyperinflammation via protein-protein interaction-mediated intracellular Cl− accumulation in respiratory epithelium”为题发表在自然出版集团(NPG)旗下国际权威学术期刊《信号转导与靶向治疗(Signal Transduction and Targeted Therapy)》(IF = 38.104,中科院1区Top期刊)上,并以当期封面故事展示。该研究借助多种技术手段(包括电生理学评价),发现SARS-CoV-2核衣壳蛋白可通过蛋白质-蛋白质互作的机制引起呼吸道上皮细胞氯离子通道囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)表达下调并诱发氯离子在细胞内积累,进而导致机体过度炎症的发生。
图1. 研究论文首页截图

图2. 《Signal Transduction and Targeted Therapy》2022年第8期封面(封面图片将呼吸道上皮细胞描绘为一个桃源仙境,其中代表氯离子的河流通过细胞膜城墙上的CFTR大门流出;SARS-CoV-2感染时,CFTR大门关闭,从而导致细胞内氯离子积累与炎症因子风暴的发生)
研究背景与意义
由SARS-CoV-2感染所引起的新型冠状病毒肺炎(Coronavirus disease 2019,COVID-19)正威胁着全球健康。然而,针对COVID-19的特异性药物仍较缺乏,其主要原因在于目前对SARS-CoV-2引起呼吸系统损伤的机制了解不足。炎症在肺损伤的病理机制中扮演着至关重要的角色,其本质是一种防御反应,是机体在遭受感染或伤害性刺激后所进行的保护性措施,对维持组织稳态平衡具有十分重要的意义。然而,炎症反应若失去控制转化为持续而过度的慢性反应,则将造成严重的不良后果。本项成果是在国际范围内率先报道的系统性阐述细胞内氯离子信号通路在SARS-CoV-2结构蛋白诱导的炎症反应中的作用机制研究,对COVID-19的新型治疗策略探索与药物研发具有重要的理论指导意义。
研究结果
本研究以呼吸道上皮细胞株和原代培养的人气道上皮细胞为体外研究模型,结合病毒蛋白气道内滴注与SARS-CoV-2直接攻毒的小鼠在体模型,利用电生理学、分子生物学、细胞生物学等实验技术发现SARS-CoV-2核衣壳蛋白刺激可通过下调氯离子通道CFTR,显著抑制了呼吸道上皮细胞分泌氯离子。进一步研究发现,SARS-CoV-2核衣壳蛋白可直接与Smad3蛋白相互作用,通过募集miRNA-145介导CFTR的表达下调。鉴于跨细胞氯离子分泌受阻很可能会导致细胞内氯离子稳态失衡,该研究通过显微离子成像技术进一步发现了SARS-CoV-2核衣壳蛋白刺激可引起呼吸道上皮细胞内氯离子浓度异常升高,进而通过激活下游的氯离子敏感蛋白——血清糖皮质激素调节激酶1(serum glucocorticoid regulated kinase 1,SGK1)介导NF-κB信号通路活化,诱导炎症反应的发生。此外,SARS-CoV-2核衣壳蛋白还可以通过介导磷酸二酯酶4(phosphodiesterase 4,PDE4)的表达上调,降低细胞内cAMP水平,进一步引起CFTR关闭,促使细胞内氯离子浓度维持在高水平,从而引起炎症反应迁延不愈。与之相反,抑制/敲除SGK1,或予以PDE4抑制剂干预均可抑制SARS-CoV-2核衣壳蛋白刺激所引起的炎症反应。
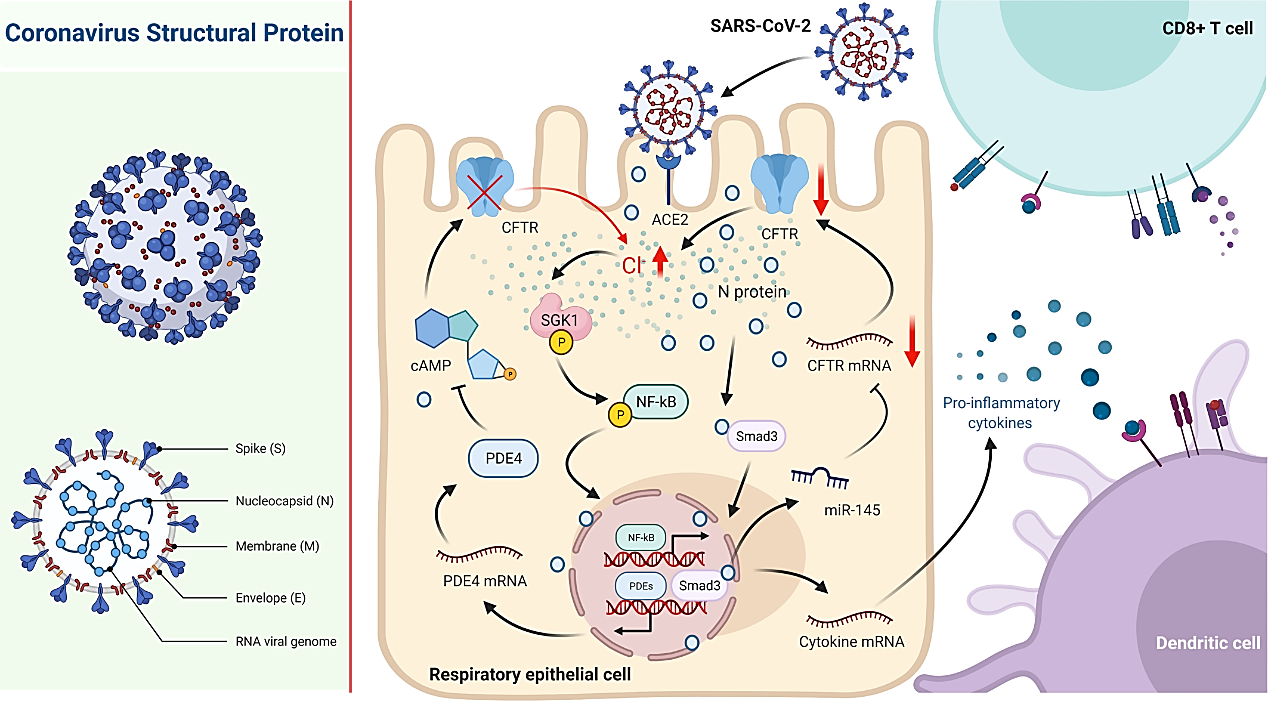
图3. 细胞内氯离子调控SARS-CoV-2所致呼吸道上皮炎症的机制模式
研究的创新性与临床意义
近年来,在多种慢性疾病的发病过程中均观察到了细胞内氯离子稳态失衡的现象[1-6]。本研究首次系统性阐明了细胞内氯离子信号通路在病毒感染所致呼吸上皮损伤中的作用机制。值得注意的是,在2018年发表于NPG旗下免疫学国际权威期刊Mucosal Immunology的论文中,该联合研究团队开创性地发现了一种新型的氯离子感应蛋白SGK1,并系统性地阐释了细胞内氯离子在细菌感染所致慢性气道炎症性疾病(特别是支气管扩张症)中的炎症信号转导作用及其分子机制[2]。此后于2019、2021年分别发表于寄生虫学国际知名期刊International Journal for Parasitology与PLoS Neglected Tropical Diseases的2篇论文中,研究团队进一步验证了细胞内氯离子异常积累在寄生虫感染所致生殖道上皮损伤中也发挥了重要的作用[3-4]。结合本研究成果,细胞内氯离子异常累积普遍存在于病原体感染的过程中,这为该团队所提出的氯离子作为病理性第二信使的概念提供了坚实的理论依据,而以控制细胞内氯离子浓度为靶点的策略或可为包括COVID-19在内的多种疾病的治疗提供新的探索方向。
该研究论文第一作者为中山大学陈磊、邱卓尔博士及广州医科大学关伟杰研究员、徐建邦博士,通讯作者为广州医科大学钟南山院士、中山大学周文良教授、张艺林副研究员。广州医科大学赵金存教授团队为该工作的动物模型实验研究提供了重要支持。该工作得到广州呼吸健康研究院开放课题(中国恒大集团所提供资金资助)、广东省钟南山医学基金会科研资助基金及国家自然科学基金等项目的资助。
参考文献
[1]Wang G, Nauseef WM. Salt, chloride, bleach, and innate host defense. J Leukoc Biol. 2015 Aug; 98(2): 163-172.
[2] Zhang YL, Chen PX, Guan WJ, Guo HM, Qiu ZE, Xu JW, Luo YL, Lan CF, Xu JB, Hao Y, Tan YX, Ye KN, Lun ZR, Zhao L, Zhu YX, Huang J, Ko WH, Zhong WD, Zhou WL, Zhong NS. Increased intracellular Cl− concentration promotes ongoing inflammation in airway epithelium. Mucosal Immunol. 2018 Jul; 11(4): 1149-1157.
[3] Xu JB, Zhang YL, Huang J, Lu SJ, Sun Q, Chen PX, Jiang P, Qiu ZE, Jiang FN, Zhu YX, Lai DH, Zhong WD, Lun ZR, Zhou WL. Increased intracellular Cl− concentration mediates Trichomonas vaginalis-induced inflammation in the human vaginal epithelium. Int J Parasitol. 2019 Aug; 49(9): 697-704.
[4] Xu JB, Lu SJ, Ke LJ, Qiu ZE, Chen L, Zhang HL, Wang XY, Wei XF, He S, Zhu YX, Lun ZR, Zhou WL, Zhang YL. Trichomonas vaginalis infection impairs anion secretion in vaginal epithelium. PLoS Negl Trop Dis. 2021 Apr 16; 15(4): e0009319.
[5] Han H, Liu C, Li M, Wang J, Liu YS, Zhou Y, Li ZC, Hu R, Li ZH, Wang RM, Guan YY, Zhang B, Wang GL. Increased intracellular Cl− concentration mediates neutrophil extracellular traps formation in atherosclerotic cardiovascular diseases. Acta Pharmacol Sin. 2022 May 5. doi: 10.1038/s41401-022-00911-9.
[6] Yang HY, Zhang C, Hu L, Liu C, Pan N, Li M, Han H, Zhou Y, Li J, Zhao LY, Liu YS, Luo BZ, Huang XQ, Lv XF, Li ZC, Li J, Li ZH, Wang RM, Wang L, Guan YY, Liu CZ, Zhang B, Wang GL. Platelet CFTR inhibition enhances arterial thrombosis via increasing intracellular Cl− concentration and activation of SGK1 signaling pathway. Acta Pharmacol Sin. 2022 Mar 3. doi: 10.1038/s41401-022-00868-9.
论文原文:https://www.nature.com/articles/s41392-022-01048-1