钟南山/杨子峰/李迎君教授团队在Acta Pharm Sin B发表综述:流感聚合酶三类抑制剂从基础到临床应用进展
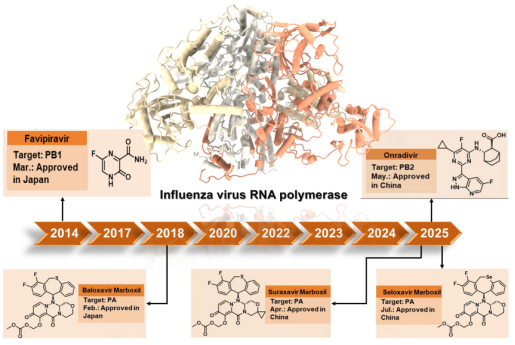
2025-12-1252钟南山院士、杨子峰教授、李迎君教授团队在Acta Pharmaceutica Sinica B杂志上发表题为“Anti-influenza drugs targeting trimeric RNA polymerase complex: from development to clinics”的综述文章。文章系统回顾了由PA、PB1和PB2三个亚基组成的流感聚合酶的催化机制、针对各亚基的抑制剂作用模式,以及从研发到临床应用近十年的重要进展。自2014年PB1抑制剂法匹拉韦获批上市以来,全球近十年获批的5个抗流感新药均为聚合酶抑制剂,标志着流感创新药研发已进入“聚合酶时代”。2025年,中国相继批准了两款PA抑制剂玛舒拉沙韦与玛硒洛沙韦,以及全球首创新药(first-in-class)PB2抑制剂昂拉地韦。这一系列成果充分体现了中国在抗流感创新药领域的快速发展与重要跨越。

流感是全球最重要的呼吸道传染病之一,其高变异性、跨物种传播能力和导致重症的潜力,使其在过去一个多世纪中不断引发季节性大流行乃至全球性公共卫生事件。流感聚合酶(FluPol)由PA、PB1和PB2三个亚基组成,驱动流感病毒基因组复制转录的全过程。病毒入侵宿主细胞后,包含了FluPol的病毒核糖核蛋白复合物(vRNP)进入细胞核,通过“抢帽”机制启动转录:PB2亚基的帽结合域捕获宿主pre-mRNA的5'端帽子结构,随后PA亚基发挥内切酶活性,切割宿主mRNA产生的10–15个核苷酸含有帽子结构的RNA片段。随后,PB2亚基发生构象改变,将该RNA片段送入PB1亚基的催化活性中心,启动病毒mRNA的合成。随着结构生物学技术的成熟,聚合酶三亚基协同催化转录与复制的分子机制日益清晰,为基于结构的药物设计(SBDD)实现靶点口袋的精准适配及药物开发奠定了坚实基础。
1、PA抑制剂
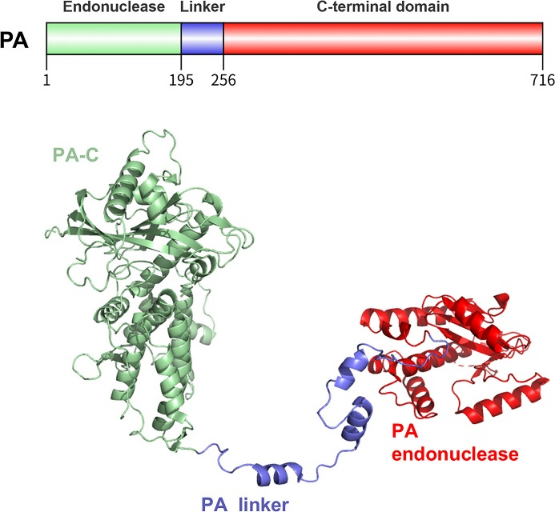
流感病毒聚合酶的PA亚基(约25 kD)包含一个N端帽依赖型内切酶(CEN)结构域和一个较大的C端结构域。PA的C端结构域与PB1的N端片段紧密结合,从而稳定三聚体聚合酶复合物并促进功能整合。在转录起始过程中,PA会发生构象变化,将带有帽子的RNA片段重新定位至PB1的催化位点。PA亚基N端CEN属于PD-(D/E)XK核酸酶超家族,其活性中心(His41、Glu80、Asp108、Glu119)通过螯合二价金属离子(Mg²⁺/Mn²⁺)发挥功能。PA抑制剂通过结合该活性中心周围的疏水空腔并竞争性螯合金属离子,从而阻断PA切割宿主RNA,抑制“抢帽”过程。
第一个靶向PA药物玛巴洛沙韦(Baloxavir Marboxil),2018年在日本首先上市。巴洛沙韦分子结构的灵感一部分来源于HIV整合酶抑制剂多替拉韦的三环药效团,通过三齿配位方式螯合双金属离子;另一部分是疏水的三环尾部,通过范德华力与周围残基相互作用,实现高亲和力结合。在大鼠和猴子的口服药代动力学试验中,巴洛沙韦口服生物利用度不高。在羟基上连接甲氧基(甲基)碳酸酯形成前药玛巴洛沙韦,提高了口服吸收。口服给药后,玛巴洛沙韦主要在肠腔、上皮细胞、肝脏和血液中被芳基乙酰胺脱乙酰酶快速代谢为活性形式。该药半衰期长(99.7小时),临床治疗为单剂给药,体重低于80公斤的成年患者服用40毫克,体重80公斤或以上的患者服用80毫克。由于流感病毒的高度突变性,玛巴洛沙韦的使用伴随着耐药突变的出现。在细胞培养中,逐渐增加药物浓度连续传代后,观察到了对巴洛沙韦敏感性降低的甲型流感病毒毒株。PA蛋白抑制剂结合口袋附近发生的氨基酸替换——包括A/H1N1的E23K/R和I38T/F/N;A/H3N2的E23G/K、A37T、I38T/M和E199G;乙型流感病毒(IBV)I38T——降低了甲型流感病毒对巴洛沙韦的敏感性。最为普遍的I38T突变使甲型流感病毒的敏感性降低了约30至50倍。共晶结构表明,38位氨基酸突变为极性更强的苏氨酸后削弱了靶标与巴洛沙韦的范德华相互作用。此外,T38及其邻近的M34的侧链均发生构象变化,导致化合物疏水口袋发生改变。因此,巴洛沙韦与T38变异体结合需要局部的诱导契合重排,增加了结合难度。在接受巴洛沙韦治疗的甲型和乙型流感患者中均检测到了与巴洛沙韦敏感性降低相关的氨基酸点突变。
2025年在中国获批的PA抑制剂玛舒拉沙韦(Suraxavir Marboxil)及玛硒洛沙韦(Seloxavir)在结构上与玛巴洛沙韦相似。玛舒拉沙韦在玛巴洛沙韦三环金属配位骨架基础上引入了螺环丙烷结构。临床研究表明,单次给药(40 mg)可较安慰剂缩短症状缓解时间约20.3小时。玛硒洛沙韦则通过将硫原子生物电子等排为硒原子,提高分子极化性和代谢稳定性。临床数据显示单次口服80 mg可使成人流感症状缓解时间从63小时缩短至39小时,对甲、乙型流感均具良好抑制效果。在临床试验中,成人患者服用舒拉沙韦或硒洛沙韦后检测到的耐药突变发生率较低,儿童患者中尚无相关报道。
此外,玛帕西沙韦(Pixavir Marboxil)与玛氘诺沙韦(Deunoxavir Marboxil)两款在研PA抑制剂完成了III期临床试验并提交了新药上市申请;AL-794,WXSH-0208等候选化合物处于临床开发阶段。
2、PB1亚基抑制剂
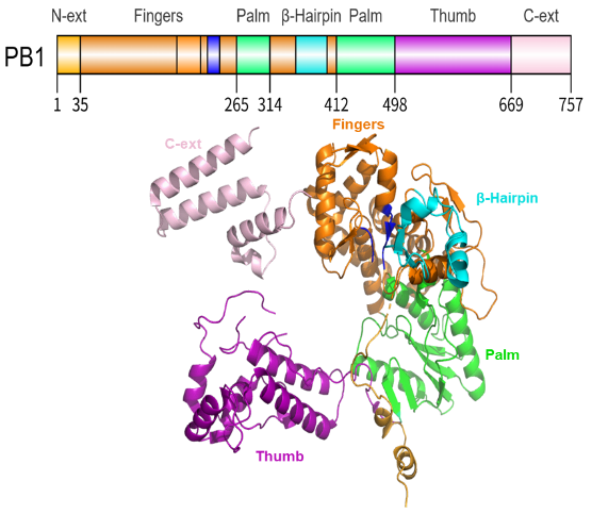
PB1是FluPol催化RNA合成的核心,具有典型"右手状"结构(掌域、指域、拇指域)。PB1与PB2的N端结构域相互作用,在聚合酶内部形成一个中心空腔。该空腔容纳催化活性位点,作为核苷三磷酸和RNA模板进入的枢纽,同时允许模板和新生RNA产物的释放。在PB1活性位点内,多个保守基序螯合磷酸二酯键形成所需的镁离子,从而实现核苷三磷酸掺入不断延长的RNA链。PB1在其内部空腔结合病毒RNA模板的3′和5′末端,维持一种闭合构象以促进RNA的持续合成能力。其N端结构域与PA的C端紧密互作,而C端区域则与PB2的N端结合,从而实现了引物获取活性与RNA聚合活性间的动态变化。
靶向PB1的药物主要为核苷类似物,法匹拉韦(Favipiravir)于2014年在日本上市。该药在细胞内经次黄嘌呤-鸟嘌呤磷酸核糖转移酶催化转化为单磷酸形式,进一步磷酸化生成活性三磷酸代谢物,通过模拟鸟苷掺入病毒RNA引发致死性突变,从而发挥抗病毒作用。法匹拉韦对流感病毒的半数有效浓度(EC50)介于0.19至22.5 μM之间。法匹拉韦还对多种RNA病毒表现出广谱抗病毒活性,包括黄病毒、甲病毒、丝状病毒、布尼亚病毒、沙粒病毒、诺如病毒等,其中许多是尚无特异性治疗方法的被忽视的或(重新)出现的病原体。这些独特的抗病毒特性使法匹拉韦成为治疗某些目前无特效药的RNA病毒感染的一种潜在药物。它曾被超适应症用于治疗埃博拉和拉沙热等疾病,但由于缺乏规范临床试验数据,其抗埃博拉病毒的临床疗效尚未得到证实。
安全性问题,特别是致畸性和胚胎毒性方面的担忧,限制了法匹拉韦在孕妇和儿童中的使用。常见的不良反应包括轻微的胃肠道症状和无症状性高尿酸血症,严重不良事件的发生率低于1%。目前法匹拉韦在临床主要在其它抗流感病毒药品治疗无效或效果不佳时使用。体外研究显示,PB1-K229R与PA-P653L等突变可介导耐药,但迄今未在临床分离株中检测到,提示其耐药屏障相对较高。在重症流感治疗中,法匹拉韦与神经氨酸酶抑制剂的联合应用显示出加速病毒清除的潜力。
3、PB2亚基抑制剂
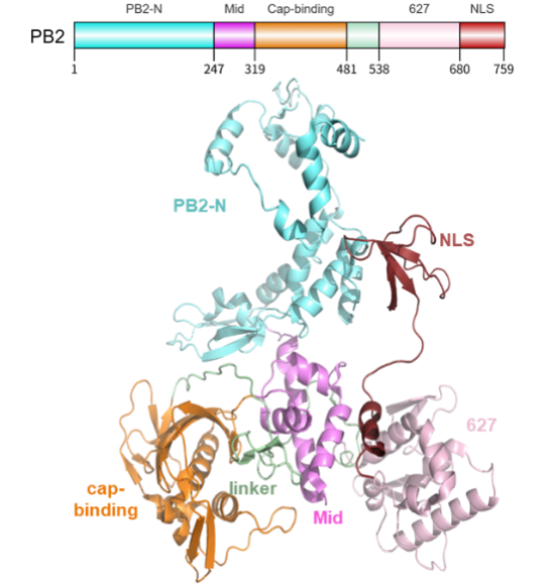
PB2亚基具有高度模块化的结构特征和构象可塑性。可分为N端三分之一部分(PB2-N)和C端三分之二部分。C端部分包含中间连接区(该区域可进一步细分为中部、帽结合部和连接部),以及627结构域和核定位信号(NLS)结构域。其帽结合域负责识别宿主mRNA 5'端的7-甲基鸟苷帽(m7 GpppN)结构,为病毒转录提供引物来源。PB2抑制剂占据该帽结合位点,并通过氢键、空间占据、疏水补偿等与口袋周围残基相互作用提升结合稳定性。
匹莫地韦(Pimodivir, VX-787)是由强生旗下杨森制药开发的口服PB2抑制剂。它通过竞争性占据PB2帽结合位点并稳定其非活性“apo”构象来发挥作用,主要对甲型流感病毒有效,对乙型流感病毒活性较弱。由于其III期临床试验疗效未能优于奥司他韦,研发已终止。CC-42344是通过基于结构的药物设计开发的PB2抑制剂,对奥司他韦和巴洛沙韦耐药株有效,目前处于II期临床阶段。
昂拉地韦(Onradivir)是2025年在中国获批的全球首个上市PB2抑制剂。昂拉地韦对甲型流感病毒(H1N1,H3N2)表现出强效抑制活性,EC50值在0.01至0.063 nM之间,显著优于奥司他韦和巴洛沙韦。它对奥司他韦耐药株、巴洛沙韦耐药株及高致病性禽流感病毒毒株也显示出强效抑制活性(EC50 < 1 nM)。在小鼠和雪貂模型中,昂拉地韦能剂量依赖性地降低病毒滴度并提高存活率。其分子设计通过在嘧啶环6位引入环丙基,不仅增强其与PB2的结合亲和力,还进一步降低P-糖蛋白外排并提升代谢稳定性。分子对接显示,环丙基占据疏水口袋,吡唑环与Glu361形成双齿氢键,羧基与Arg355形成盐桥,整体结构刚性增强提升了蛋白结合效率。Ⅲ期临床试验以每日一次剂量连续服用5天,主要疗效终点是从首次给药到首次观察到所有七项流感症状(咳嗽、咽痛、头痛、鼻塞、发热或寒战、肌肉或关节疼痛、疲劳)均得到缓解。昂拉地韦组的症状缓解时间(TTAS)为38.83小时,比安慰剂组(63.35小时)缩短了39%,比奥司他韦组(42.17小时)缩短了8%。昂拉地韦显示出更快、更大幅度的病毒滴度和RNA载量下降,病毒清除时间中位数为68.65小时,优于安慰剂组(86.03小时)和奥司他韦组(88.62小时),证明了其比奥司他韦更有效的抗病毒疗效。昂拉地韦对奥司他韦和巴洛沙韦耐药株仍保持抑制活性,为流感治疗提供了全新作用机制的用药选择。在这两项临床试验中,昂拉地韦治疗后敏感性降低的突变发生率低,且EC50降低倍数较小,具有较高的耐药屏障。
随着三类亚基靶向药物相继上市,以流感病毒聚合酶为靶点的抑制剂已形成覆盖多亚基、作用机制多元化的全新治疗格局,显著拓宽了临床流感治疗选择。FluPol抑制剂的研发历程,成功运用了基于结构的药物设计(SBDD)、刚性化配体-靶点相互作用策略以及前药设计等多种策略,为抗病毒药物研发提供了宝贵经验。当前,高致病性禽流感(如H5N1、H5N6与H7N9)仍在全球范围内构成持续威胁,而神经氨酸酶抑制剂对其疗效有限。相比之下,新一代FluPol抑制剂展现出更突出优势:玛巴洛沙韦能有效抑制多种高致病性禽流感毒株(包括奥司他韦耐药株),PB2抑制剂昂拉地韦对禽流感毒株的IC50在亚纳摩尔水平,并对奥司他韦和玛巴洛沙韦耐药株保持高效抑制。2024-2025年北美H5N1疫情的暴发再次引发全球关注,聚合酶抑制剂及其联合用药组合有望成为未来禽流感防控潜在的治疗手段。然而,流感病毒的高突变率使耐药性始终成为流感治疗面临的核心挑战。尽管目前尚未发现跨不同类别抑制剂的交叉耐药突变,但持续的耐药监测仍不可或缺。除探索多靶点联合治疗外,开发具备全新作用机制的药物也至关重要,未来的抗流感药物研究将继续沿着新机制探索和结构创新方向深入拓展。
本文的通讯作者为钟南山院士、杨子峰教授和李迎君教授。第一作者为李迎君教授。中-葡人工智能与公共卫生问题"一带一路"联合实验室和国家自然科学基金委提供了基金支持。