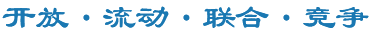肺癌患者该不该用免疫治疗?实验室何建行教授团队找到最新算法
2020-05-143494近日,由广州医科大学附属第一医院、实验室何建行教授团队开展的一项关于优化定义血液肿瘤突变负荷(bTMB)用于预测免疫治疗获益的研究在线发表于Journal of Thoracic Oncology杂志(IF=12.5)——相关成果“A Modified Algorithm Adjusting Both High and Minor Allele Frequency Mutation to Redefine Blood-Based Tumor Mutational Burden (bTMB) for Optimal Prediction of Clinical Benefits From Immune Checkpoint Inhibitor Therapy”。
以PD-1/PD-L1阻断为首的免疫治疗使得一部分晚期患者取得长期缓解甚至临床治愈,但有效的优势人群比例不高(20%左右),找到获益人群,精准指导治疗非常重要。前期一项发表于Nature Medicine的研究已经证实通过血液计算肿瘤突变负荷,可以预测免疫治疗获益。本项研究中,何建行教授团队进一步挖掘到bTMB指导免疫治疗效能的潜在影响因素(最大突变频率及ctDNA突变丰度异质性)并加以校正,重新定义了更加精准的“优化-bTMB”,并证明其优于当前国际主流算法,能够更准确预测免疫治疗的ORR,PFS以及OS。本研究由何建行、梁文华教授共同指导,南山班毕业生刘智超为第一作者完成。
研究相关背景
肿瘤突变负荷(tumor mutational burden,TMB)高,提示基因不稳定性,可以诱导新抗原的产生,进一步改善免疫原性。既往多项研究显示TMB可预测免疫治疗效果,并被列入2019年NCCN指南。但约30%的晚期肺癌患者常常存在无法获取肿瘤组织、肿瘤组织标本不够或肿瘤组织含量不符合检测要求等问题,在临床实际需求下,基于血液检测的TMB(bMB)应运而生。关于bTMB首个验证性文章发表于《Nature Medicine》,证实了bTMB对免疫治疗疗效(PFS、ORR)预测的有效性。理论上,免疫治疗上的获益可以带来显著长期生存,这也是免疫治疗的亮点和优势。但遗憾的是,目前的bTMB仍不足以预测免疫治疗患者的总生存(OS)。鉴于此,bTMB对免疫治疗临床获益的预测效能还有待改善,当前bTMB的算法有进一步优化的空间。
bTMB是正在不断研究发展中的预测标志物,为了探索影响bTMB预测效能的潜在因素,研究团队从ctDNA的特点出发,经过数据分析,发现了这一现象背后的可能生物学机制并提出了优化bTMB算法。
研究假设
由于肿瘤细胞存在很强的异质性,基于ctDNA检测的bTMB,从理论上来说,更能反映肿瘤整体上的综合信息。除此之外,ctDNA也与肿瘤负荷相关。理论上,肿瘤中突变的基因越多,可能产生的新生抗原会越多,就越有可能被免疫系统识破,从而激活人体的抗癌免疫反应,因此对肿瘤免疫治疗的疗效就越好。但并非所有的突变能产生新生抗原引起免疫反应,这些突变基因需要进一步“过滤”。上述两点1)肿瘤异质性和 2)肿瘤负荷就是本研究的关注方向。
肿瘤亚克隆是肿瘤异质性的重要的体现。肿瘤内亚克隆的存在与多样性是决定抗肿瘤治疗效果的关键。既往研究显示,不同基因的突变丰度可以用来表示肿瘤的克隆组成,突变丰度高的突变基因更倾向于克隆,而低突变丰度的基因更倾向于亚克隆。何建行教授团队的前期研究发现,ctDNA突变丰度异质性(发生低频突变:存在占最高突变丰度不足10%的低比例突变肿瘤基因)是不良预后因素;具有这类低频突变的晚期肺癌患者,不管接受何种治疗(免疫、化疗、靶向治疗),生存预后更差。这些证据提示,ctDNA突变丰度异质性(低频突变亚克隆)可能导致bTMB无法准确预测免疫治疗的疗效。
另一方面,研究显示ctDNA水平可能预示着更严重的疾病和更高的整体肿瘤负荷,高水平的ctDNA(或较高的突变丰度)与较短的进展和更差的生存预后相关。较高的肿瘤负荷往往会促使更多的突变产生,有可能引起“虚高”的TMB贡献,从而对bTMB的预测效能产生“打折扣”的效果。
研究结果
何建行教授团队选择ctDNA特性的这两个分析点,利用已发表的两个bTMB临床试验的数据(Nature Med, 2018 POPLAR&OAK队列),通过数据趋势性分析肿瘤异质性(低频突变minor AF mutation)、肿瘤负荷(高频突变high AF mutation)和bTMB预测效能的关系(图1),找出了低频突变和高频突变影响bTMB的可能机制,通过校正两者,可以更加准确衡量bTMB对免疫治疗的预测效能。
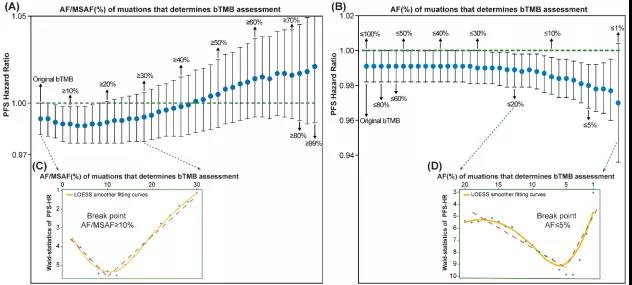
图1.(A/C)通过趋势截点分析确定合适的低比例突变以校正bTMB。(B/D)通过趋势截点分析确定合适的高比例突变以校正bTMB。(AF:突变丰度;MSAF最大体细胞突变丰度)
不管是校正低频突变(剔除AF/MSAF<10%的突变)的bTMB,还是校正高频突变(剔除AF>5%的突变)的bTMB,在预测免疫治疗的效能上均获得改善。当两者同时校正时,对免疫治疗的预测效能(PFS)进一步增加,还可以预测OS。因此,研究者在校正低频突变和高频突变的算法基础上,提出了优化bTMB (modified-bTMB)的算法模型,并在POPLAR和OAK两个大型队列中分别进行了优化bTMB的高低cut-off的确定和验证。当优化bTMB≥12时,对免疫治疗预测效能的获益最大,免疫治疗组的PFS/OS/ORR均优于化疗(图2-3)。
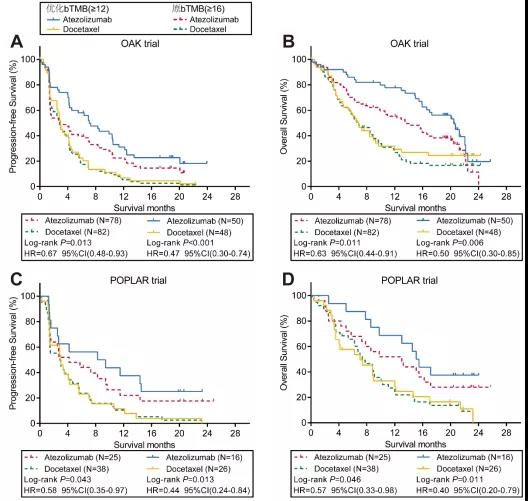
图2.优化bTMB相比于原bTMB,预测免疫治疗的获益区分更大(PFS、OS)

图3.优化bTMB、原bTMB的客观缓解率(ORR)
优化bTMB不仅在PFS上、OS上可以显著区分免疫vs化疗的获益;另外,在免疫治疗人群中,还可以实现分层获益预测。原bTMB无法预测免疫治疗的OS,而优化bTMB(高vs低)可以同时预测免疫治疗的PFS及OS(图4),证实优化bTMB对免疫治疗优势人群的预测能力得到改善。
图4.原bTMB无法预测免疫治疗的OS,而优化bTMB可以同时预测免疫治疗的PFS及OS
本研究结果表明,优化bTMB-high与PFS、OS和ORR存在显著获益相关。原bTMB-high预测223人从免疫治疗中获益,而在优化bTMB-high的指导下进一步明确免疫治疗真正获益人群和非获益人群(图5)。
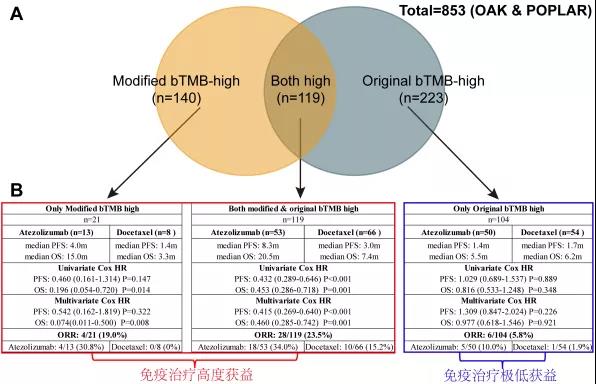
图5.优化bTMB-high 与 原bTMB-high的预测获益人群对比
综上,该团队在创新性的基础上,通过分析ctDNA突变频率与bTMB预测免疫治疗获益的关系,证实从bTMB中剔除低频突变(AF/MSAF<10%的突变)及高频突变(剔除AF>5%的突变),能够优化bTMB能有效预测免疫治疗的临床获益,为基于bTMB的免疫治疗预测提供了新的临床证据和优化思路。在晚期肺癌治疗领域,目前还没有任何一个预测标志物是完美无缺的,本研究得出的优化策略,从整体角度改善了人群使用免疫治疗的“性价比”,但也可能遗漏极少一部分可能获益的患者。总体来说,探索bTMB与免疫治疗的关系是癌症精准治疗的方向之一,目前bTMB还有其他改进空间,比如鉴定新生抗原突变、排除克隆性造血的影响等等,bTMB虽然并不完美挑战仍存,但可以确认的是,优化的bTMB已经具备指导临床的能力。