建立流感病毒与细菌共感染模型,多学科交叉见成果
2021-07-155307流感是由流感病毒感染个体引发,是影响人类健康的常见传染病之一。据保守估计,1918年流感大流行就导致全球超过5000万人死亡,而90%死亡原因是由于流感病毒诱发了细菌共感染,而并非病毒的直接作用。同样,在2009年甲型H1N1流感大流行期间,细菌共感染情况与H1N1导致的死亡率成正相关,18%-34% ICU患者合并细菌感染。肺炎链球菌、金黄色葡萄球菌、流感嗜血杆菌、卡他莫拉菌等是流感常见的合并感染菌。尽管1918年后相续引入了抗生素和流感疫苗,但病毒合并细菌感染导致的死亡仍是一个重要的问题。
实验室杨子峰教授课题组致力于呼吸道病毒的诊断和防治研究,充分发挥基础和临床结合,利用病毒、药理及临床等多学科交叉,在流感病毒和细菌共感染研究方向不断探索,并取得重要成果,特别是流感病毒和细菌共感染模型的建立,为后续机制和防治策略的研究奠定了基础。
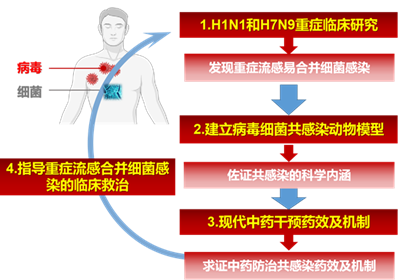
图1 从临床-模型-药物的共感染研究循环
在甲流H1N1重症临床研究中,杨子峰教授课题组发现H1N1病毒感染可激活趋药性和细胞运动性相关基因,使机会致病菌更易在下呼吸道定植和合并感染[1]。后续禽流感H7N9研究中,通过开发转录组学分析新方法(MDTH, Molecular distance to health),确定与临床密切相关的关键宿主反应和转录特征;首次证实人重症H7N9 的MDTH 与下呼吸道病毒载量及细菌感染相关;进一步也发现CD177、MMP9、MGAM2 等8个固有免疫调控基因与重症细菌共感染密切相关,证实了重症禽流感更易合并细菌感染观点[2]。
介于临床样本资源的有限和困难,为深入探讨流感病毒合并细菌感染的发生发展机制及药物筛选和治疗评价等,根据流感常见的合并感染菌,杨子峰团队先后建立了流感病毒继发金黄色葡萄球菌(SA)[3],继发耐甲氧西林金黄色葡萄球菌(MRSA)[4]和继发流感嗜血杆菌(NTHi)[5]感染肺炎小鼠模型。与单因素病毒或细菌感染相比,这些合并感染模型在肺部炎症因子和病理损伤方面表现更为明显,死亡率也显著增加,具有发病机理同源性和行为表象一致性,同时也具有创建易行性和经济可行性的特点。
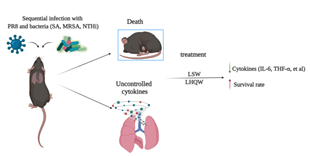
图2 共感染模型建立及药物干预示意图
应用共感染小鼠模型,杨子峰教授团队进行了药物干预药效及相关机制的初步探索,发现流感病毒感染可促进黏附分子的表达,并与肺内细菌滴度具有正相关关系,提示黏附分子可能在流感病毒促发细菌感染中具有一定作用。应用中药连花清瘟及六神丸分别对流感病毒和金黄色葡萄球菌共感染模型进行干预,发现其对共感染引起的严重肺炎具有保护作用,均可明显改善肺病理损伤、降低肺部炎症因子表达,尤其六神丸还可延长共感染小鼠的生存时间;而其保护作用机制很可能通过抑制黏附分子的上调,从而抑制流感病毒感染后细菌的黏附实现的。后续在三种不同共感染动物模型的基础上,将进一步探讨共感染发生发展机制和药物干预药效评价,为临床重症流感的防治策略和药物选择提供依据。
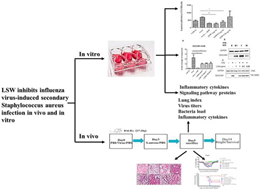
图3 六神丸抑制流感病毒继发金黄色葡萄球菌感染
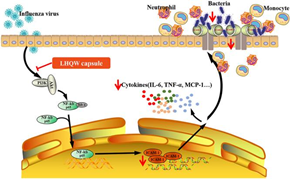
图4 莲花清瘟抑制流感病毒继发MRSA感染
整个流感病毒和细菌共感染研究工作由实验室杨子峰教授组织开展,王新华教授及昆明医科大学药学院杨为民研究员提供了重要帮助,赵瑾博士、杜秋伶博士和吴晓硕士等研究生协作完成,3篇文章先后发表在J Ethnopharmacol和Microbes Infect杂志。并得到了国家重点研发计划(2017YFC1309302;2020YFA0708002),国家自然科学基金(81873065;82004033; 82074311),澳门科技发展基金(125/2017/A3)等项目的资助。

参考文献
[1] Leung RK, Zhou JW, Guan W, Li SK, Yang ZF, Tsui SK. Modulation of potential respiratory pathogens by pH1N1 viral infection. Clin Microbiol Infect. 2013 Oct;19(10):930-5. doi: 10.1111/1469-0691.12054. Epub 2012 Nov 20. PMID: 23167452.
[2] Guan W, Yang Z, Wu NC, Lee HHY, Li Y, Jiang W, Shen L, Wu DC, Chen R, Zhong N, Wilson IA, Peiris M, Mok CKP. Clinical Correlations of Transcriptional Profile in Patients Infected With Avian Influenza H7N9 Virus. J Infect Dis. 2018 Sep 8;218(8):1238-1248. doi: 10.1093/infdis/jiy317. PMID: 29846612; PMCID: PMC6129114.
[3] Zhao J, Huang X, Wang Y, Ma Q, Song J, Wu X, Zhou H, Weng Y, Yang Z, Wang X. Liu Shen Wan inhibits influenza virus-induced secondary Staphylococcus aureus infection in vivo and in vitro. J Ethnopharmacol. 2021 Mar 22:114066. doi: 10.1016/j.jep.2021.114066. Epub ahead of print. PMID: 33766755.
[4] Du Q, Huang W, Zhao J, Zeng J, Zhang W, Huang X, Chen R, Jiang H, Xie Y, Wang Y, Zhong N, Wang X, Yang Z. Lianhuaqingwen capsule inhibits influenza-induced bacterial adhesion to respiratory epithelial cells through down-regulation of cell adhesion molecules. J Ethnopharmacol. 2021 Apr 16:114128. doi: 10.1016/j.jep.2021.114128. Epub ahead of print. PMID: 33872750.
[5] Wu X, Li R, Weng Y, Zhou H, Jiang H, Zhao J, Liu B, Chen R, Chen X, Yang W, Yang Z, Wang X. Correlation of adhesion molecules and non-typeable haemophilus influenzae growth in a mice coinfected model of acute inflammation. Microbes Infect. 2021 May 20:104839. doi: 10.1016/j.micinf.2021.104839. Epub ahead of print. PMID: 34023525.