研究发现Skp1与F-box的相互作用被小分子破坏而成为潜在肺癌治疗靶点的分子机制
2022-08-043775CRLs是泛素蛋白酶系统(ubiquitin proteasome system, UPS)的最大家族,在很多胞内过程、生理、以及疾病(如癌症)中,扮演重要角色。SCF (Skp1-Cullin1-F-Box)复合物是CRLs中研究最清楚的成员之一,并已成为有效的癌症治疗的药物靶标。目前,关于靶向SCF的抗癌治疗的研究与日俱增。
近期,实验室副主任刘劲松研究员团队在iScience (Cell Press)上发表题为“A small-molecule Skp1 inhibitor elicits cell death by p53-dependent mechanism”的文章,报道了一个喹啉衍生的小分子Z0933M可以破坏SCF E3连接酶功能,进一步提示SCF可能成为癌症治疗靶点。本研究主要聚焦新的肺癌治疗的药物靶点Skp1,一个SCF E3连接酶复合物的中心调控组件。
通过假设驱动的基于结构的设计,该研究鉴定发现Z0933M是潜在的Skp1抑制剂,KD 值为54.7 ± 6.68 nM。另外,该化合物对22种肿瘤细胞株作用表现出较强的EC50值,数值范围在0.25 μM 到4 μM。由于Z0933M具有多环结构,占据了Skp1 C端扩展区域上一个疏水热点 (P1),Z0933M可以阻止Skp1和F-box蛋白的相互作用,而这相互作用是一个组装完整且有活性的SCF E3连接酶复合物的必要步骤。在细胞内,Z0933M通过影响SCF E3连接酶的功能,引起胞内聚泛素化水平下降,和之前报道的Skp1活性降低所造成的影响如DNA损伤一致,以及引起p53依赖的细胞凋亡。该工作提示了Z0933M可以作为研究蛋白泛素化的工具化合物,也可作为未来先导药物优化和抗癌药物研发的化学探针。
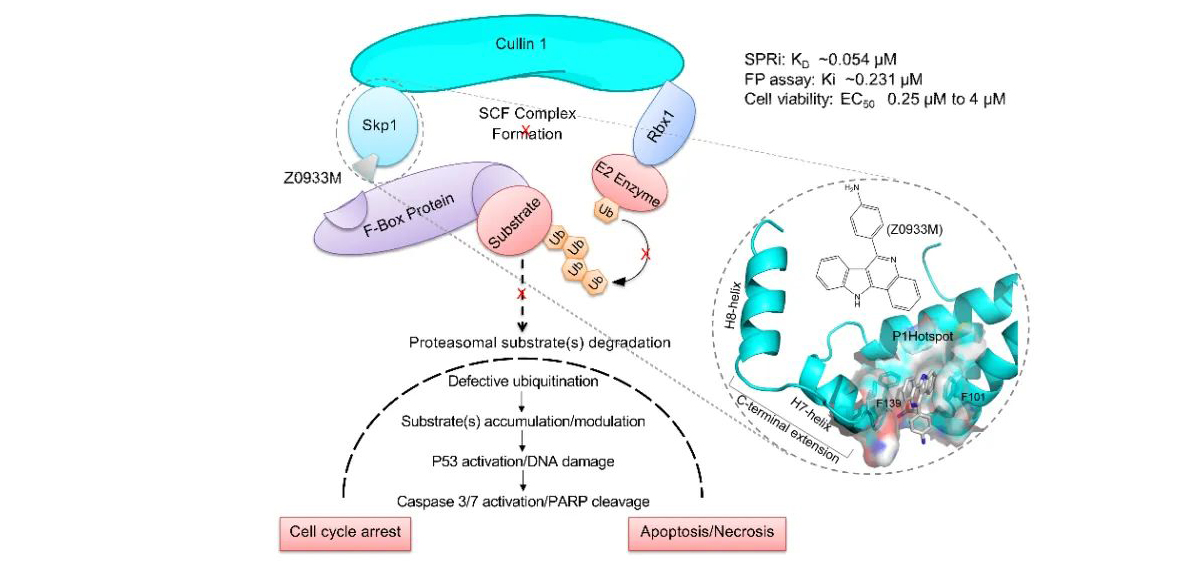
Z0993M通过结合Skp1抑制SCF泛素连接酶复合物组装并导致P53依赖的细胞凋亡示意图
Muzammal Hussain和陆永志在刘劲松研究员的指导下完成此工作,为文章共同第一作者。该研究获得国家重点研发计划、实验室自主课题、广东省生物医药计算重点实验室、广东省自然科学基金、博士后基金等项目的经费支持,并受到了实验室PI朱强研究员、张健存研究员课题组的大力支持和帮助。
Contact:
Dr. Jinsong Liu (liu_jinsong@gibh.ac.cn)
攥稿:Muzammal Hussain,许婷婷