实验室首次揭示GFAT1可作为信号转导分子参与细胞信号调控的新功能:营养压力下肺腺癌细胞依赖GFAT1活化p38促进细胞存活
2022-08-1643732022年8月9日,《Cell Discovery》杂志在线发表了实验室陈涛课题组、梁文华课题组和上海交通大学医学院附属仁济医院蒋玉辉课题组的合作文章——“GFAT1-linked TAB1 glutamylation sustains p38 MAPK activation and promotes lung cancer cell survival under glucose starvation”。文章揭示了葡萄糖缺失下,肺腺癌细胞依赖己糖胺通路代谢酶GFAT1促进p38活化和细胞存活的新机制;首次报道了GFAT1蛋白可作为信号转导分子参与细胞信号调控的新功能。

细胞代谢出现异常是肿瘤发生的重要原因之一。肿瘤细胞通过代谢(通路)重编程为其自身的无限制增殖提供所需的能量和生物大分子;在这个过程中,异常表达的代谢酶发挥了至关重要的作用[1]。与此同时,代谢酶还可以发挥调控代谢以外的功能,即参与信号通路的转导帮助肿瘤细胞应对生存压力[2]。
己糖胺通路是糖代谢中的一条重要支路,对维持细胞稳态有重要作用;研究表明其在多种肿瘤细胞中被过度激活[3,4]。谷氨酰胺-果糖-6-磷酸氨基转移酶(GFAT1)是己糖胺通路的关键限速酶,在部分肿瘤细胞中高表达,且与患者的不良预后有关[5,6]。虽然目前GFAT1对细胞存活的调节已有不少报道[7,8],但其能否发挥(己糖胺)代谢调控功能以外的功能尚未清楚。
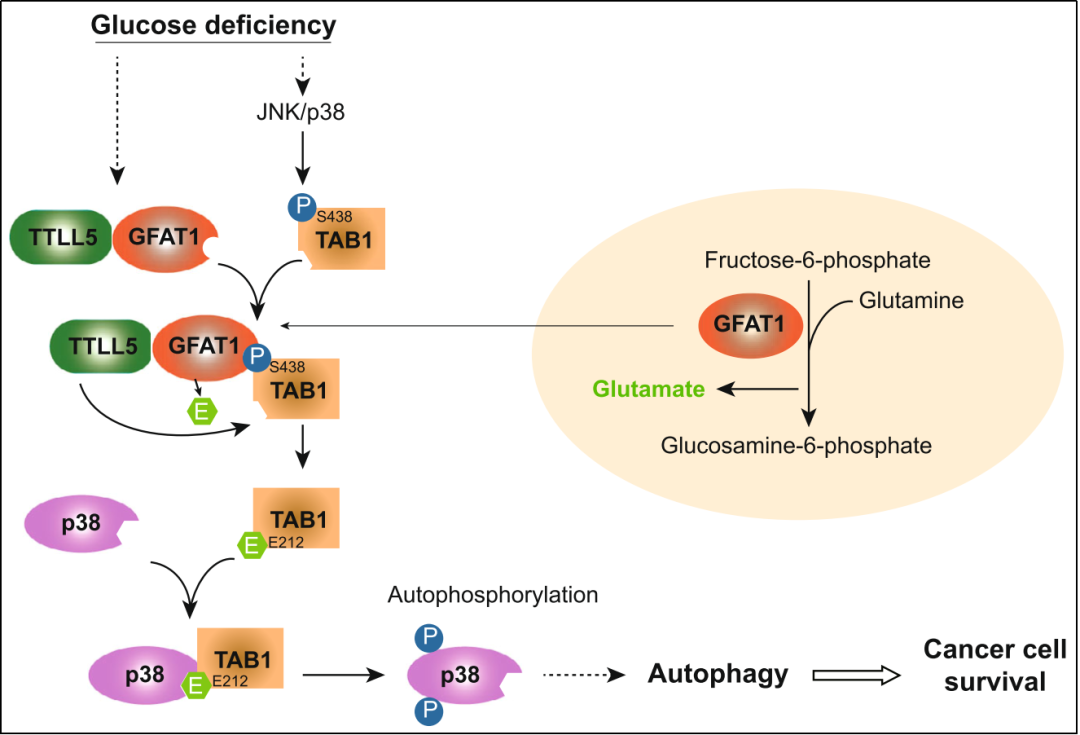
该研究显示,GFAT1在肺腺癌细胞中异常表达。在敲除GFAT1后,肺腺癌细胞在葡萄糖缺失条件下的存活受到抑制,同时,压力应激蛋白p38的活化也受到抑制;而“拯救”p38的活化可以缓解敲除GFAT1对细胞存活的抑制。进一步的蛋白质质谱和免疫共沉淀分析显示,GFAT1可以与转化生长因子β活化激酶1结合蛋白1(TAB1)以TAB1 Ser438磷酸化依赖的方式结合,后者恰恰可以通过不同途径活化p38。进一步的机制研究显示,GFAT1可以促进“TTLL5-GFAT1-TAB1”复合物的形成以及TAB1 Glu212的谷氨酸化修饰,这对于TAB1招募并活化p38至关重要。同时,在细胞生理上,GFAT1-TAB1-p38信号的活化可在一定程度上抑制肺腺癌细胞的凋亡和促进其增殖。最后的临床样本分析提示,GFAT1的高表达或TAB1 Ser438磷酸化的上调与肺腺癌患者的不良预后有关。
总之,该研究首次报道了GFAT1蛋白可作为信号转导分子参与细胞信号调控。首次揭示了肺腺癌细胞依赖GFAT1的非代谢调控功能,维持营养压力下细胞存活的新机制,为未来从代谢途径靶向干预治疗肺腺癌提供了新的理论依据。
实验室博士研究生韦庶培和赵琴副研究员(上海交通大学医学院附属仁济医院)为论文的共同第一作者;陈涛副研究员、梁文华副教授和上海交通大学医学院附属仁济医院蒋玉辉教授为论文的共同通讯作者。陈涛课题组与蒋玉辉教授课题组于2015年在钟南山院士的指导和关心下启动了肺癌细胞代谢的研究合作。这是双方2019年于美国癌症协会会刊《Cancer Research》杂志共同发表“PAK4 Phosphorylates Fumarase and Blocks TGFβ-Induced Cell Growth Arrest in Lung Cancer Cells”[9]研究成果之后的又一重要合作成果。
该研究受到国家自然科学基金、广东省自然科学基金、呼吸疾病国家重点实验室开放/自主课题、上海市科委扬帆计划和上海市教委高峰临床医学基金的经费支持;并受到华东师范大学廖鲁剑教授的技术帮助。
参考文献
1. Hay, N. Reprogramming glucose metabolism in cancer: can it be exploited for cancer therapy? Nat. Rev. Cancer 16, 635–649 (2016).
2. Xu, D. et al. The Evolving Landscape of Noncanonical Functions of Metabolic Enzymes in Cancer and Other Pathologies. Cell Metab. 33, 33–50 (2021).
3. Akella, N. M., Ciraku, L. & Reginato, M. J. Fueling the fire: emerging role of the hexosamine biosynthetic pathway in cancer. BMC Biol. 17, 52 (2019).
4. Chiaradonna, F., Ricciardiello, F. & Palorini, R. The Nutrient-Sensing Hexosamine Biosynthetic Pathway as the Hub of Cancer Metabolic Rewiring. Cells 7, 53 (2018).
5. Li, L. et al. High expression of GFAT1 predicts unfavorable prognosis in patients with hepatocellular carcinoma. Oncotarget 8, 19205–19217 (2017).
6. Yang, C. et al. High expression of GFAT1 predicts poor prognosis in patients with pancreatic cancer. Sci. Rep. 6, 39044 (2016).
7. Moloughney, J. G. et al. mTORC2 modulates the amplitude and duration of GFAT1 Ser-243 phosphorylation to maintain flux through the hexosamine pathway during starvation. J. Biol. Chem. 293, 16464–16478 (2018).
8. Moloughney, J. G. et al. mTORC2 Responds to Glutamine Catabolite Levels to Modulate the Hexosamine Biosynthesis Enzyme GFAT1. Mol. Cell 63, 811–826 (2016).
9. Chen T. et al. PAK4 Phosphorylates Fumarase and Blocks TGFβ-Induced Cell Growth Arrest in Lung Cancer Cells. Cancer Res. 2019 Apr 1;79(7):1383-1397.
论文原文:https://www.nature.com/articles/s41421-022-00423-0